《医疗器械生产质量管理规范》中5.7.1条款规定:“应当对设计和开发进行验证,以确保设计和开发输出满足输入的要求,并保持验证结果和任何必要措施的记录”。设计和开发的验证,是证明医疗器械安全有效性的重要阶段,本文结合GMP现场检查的要求,对设计开发过程的文件要求进行说明。
设计开发验证定义
依据质量管理体系中设计开发的流程,设计开发的验证工作在产品设计开发转换(即样品生产)以后,设计开发确认(临床评价)之前,见下图:
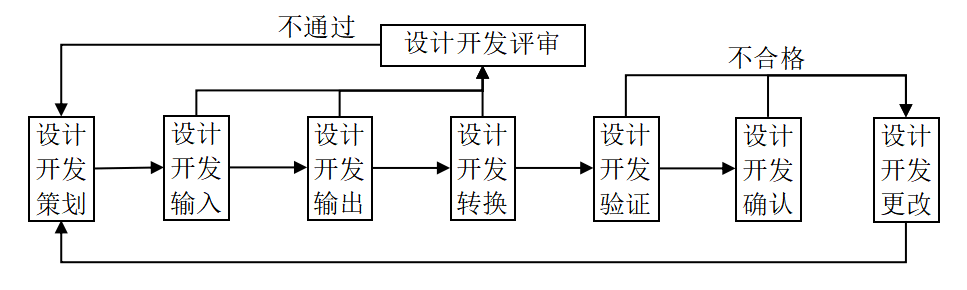
医疗器械设计开发的验证,是验证产品的设计开发输出是否满足输入的要求。设计开发输入和输出的内容主要为:
| 设计开发输入内容 | 设计开发输出内容 |
| 产品功能要求 | 技术文件:
产品技术要求、产品说明书等 |
| 性能指标要求 | 三层文件:
作业指导书、检验规程、图纸、工艺文件等 |
| 需要满足的法律法规和标准要求 | 风险管理资料:风险分析报告 |
| 产品样品或样机 | |
| 其他必要的资料 |
因此设计开发验证的主要工作就是运用客观的方法,证明产品能够满足功能和性能指标的要求,更主要的是证明产品对法律法规和标准的符合性。
设计开发验证方法
医疗器械的设计开发是要证明产品的符合性,因此从质量管理体系和产品注册两个方面考虑,主要是体系文件的确认、临床前研究两个方向,细分的方法如下:
1)文件/法规评审
组织各部门,对输出的产品技术要求、说明书、作业指导书、检验规程、工艺文件、图纸、风险管理文件等进行评审,确认文件是否符合输入的要求。
2)样品试制和测试
产品在设计开发转换过程中已经试制出样品或样机,需要对样品或样机进行检测,确认是否满足设计要求。包括注册检测、EMC检验、生物学安全性检验等。
3)变化方法计算
用不同的计算方法进行计算,考察是否能得到同一结果,已证明计算方法的可信度。一般在使用统计方法,或引用新的计算方法的研究时使用。
4)人为制造超限测试
人为制造超过产品使用限度或生产限度的条件,以测试产品的使用或生产能力的极限值。如产品有效期验证、包装和运输验证、报警测试、洁净车间最大人员负荷测试等。
5)文献研究
通过公开发表的期刊文献、教科书等查询和研究非临床文献,佐证产品研究的有效性。如产品作用机理研究、化学和物理性能研究、生物学特性研究等。
6)同类产品比较
通过和同类产品性能指标、产品组成、预期用途等进行比较,证明产品的安全有效性。即豁免临床评价的产品研究报告。
7)前代产品比较
通过和本公司前代产品性能指标、产品组成、预期用途等进行比较,证明产品的安全有效性。即豁免临床评价的产品研究报告。
8)动物实验
通过临床前动物实验,验证产品的安全性和有效性。
9)专家评审
必要时通过临床专家的评审,对产品的组成结构、预期用途、性能指标进行评审,确认产品是否具有临床意义。

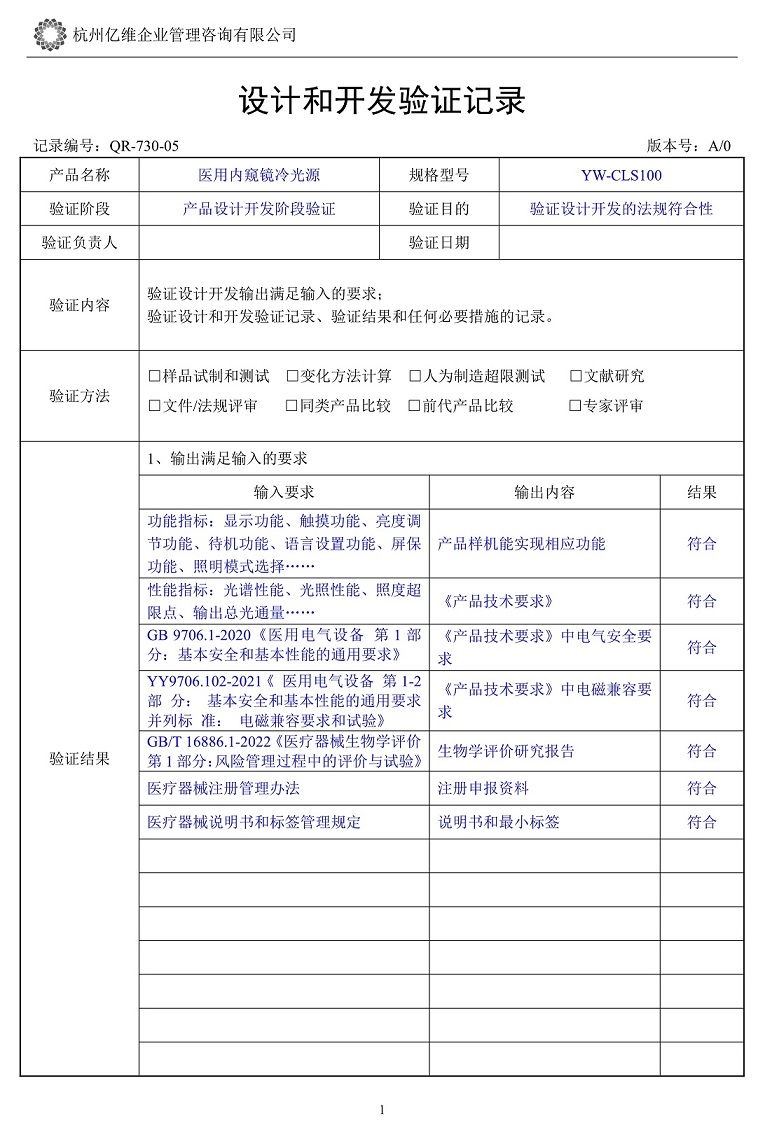
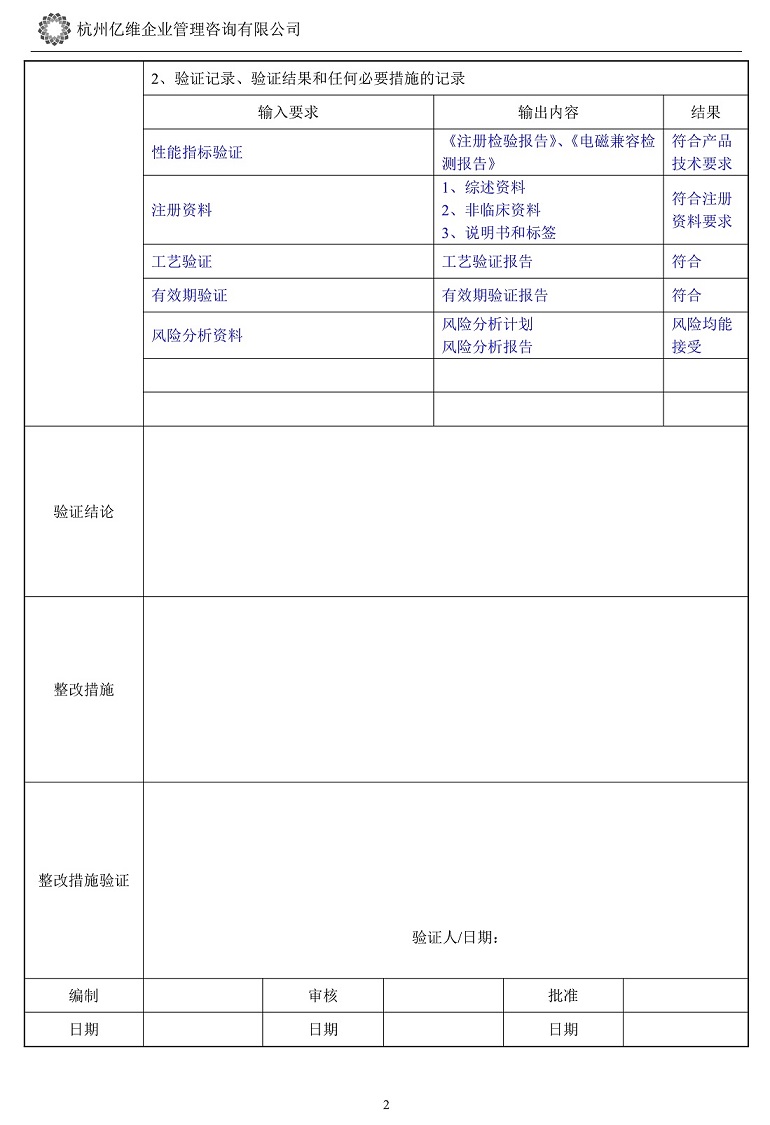
设计开发验证记录
设计开发验证记录包括《设计和开发控制程序》文件要求的质量记录,和对应的检测报告、试验报告、研究资料等。参考的《设计和开发验证记录》格式如下: