医疗器械质量管理体系是一种文件化的管理方法,体系内所有的工作流程均有质量文件作为依据,执行工作流程后均有质量记录作为证据。企业在医疗器械注册阶段的现场检查,以及上市后的日常检查、飞行检查时,质量记录是核查的重点内容。质量记录应当真实、准确、完整和可追溯,而其中核心关注点,便是可追溯性。
质量管理体系的追溯
“可追溯性”是质量管理体系的一个基础性概念,指利用质量记录的标识追溯产品的生产过程、使用情况、所处场所的能力。
对于医疗器械而言,可追溯性是指在产品出现质量问题或风险时,能够快速有效地查询到出现问题的原料或环节,必要时进行纠正预防措施,以提高产品质量水平。
国家药监局在产品质量相关的法规、通告、意见等的制定时,均强调要求医疗器械生产企业、经营企业需要在生产经营的全过程保证产品可追溯。
产品追溯是一个自后往前的过程,和产品的生产销售流程相反。
涉及的部门为和产品质量相关的所有部门,包括研发、生产、质检、采购、仓储、销售等全过程。
产品追溯需求一般来源客户投诉反馈,企业内部需要定位问题点或风险点,常规的追溯流程可见下图:
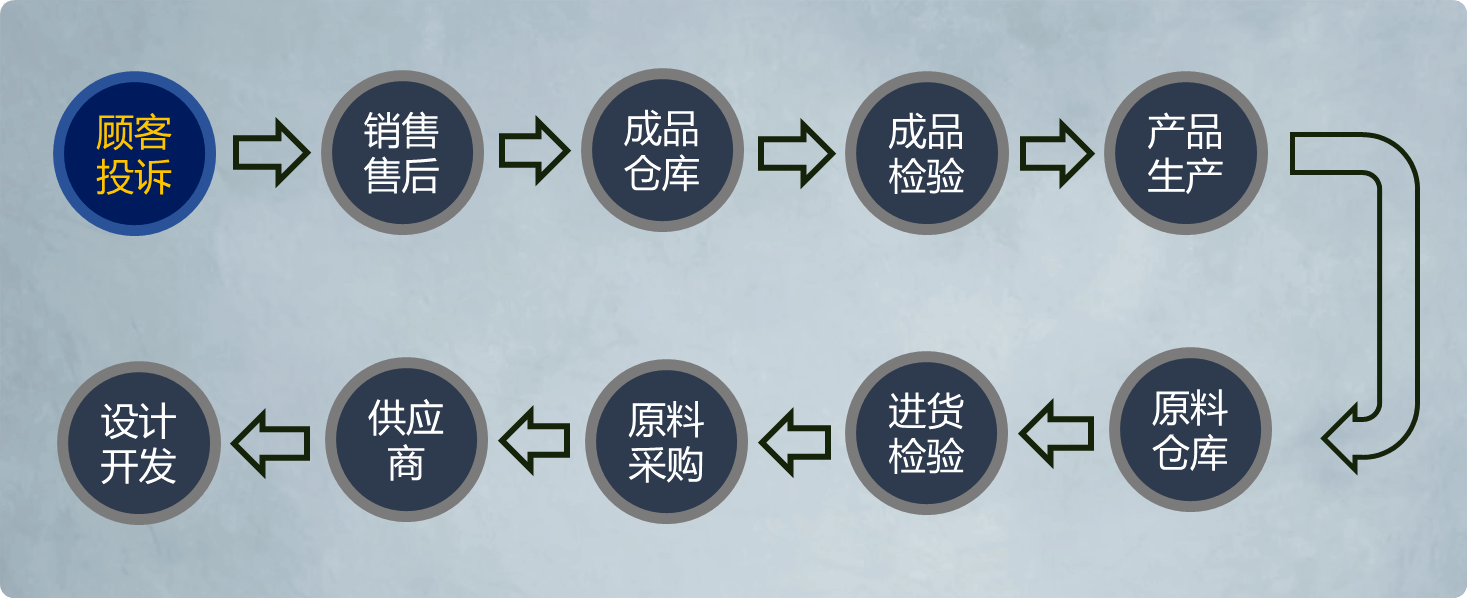
图|医疗器械追溯流程
产品追溯的要素
产品追溯一般按批次进行追溯,需要定位有问题或潜在风险的产品批次以及相关过程。
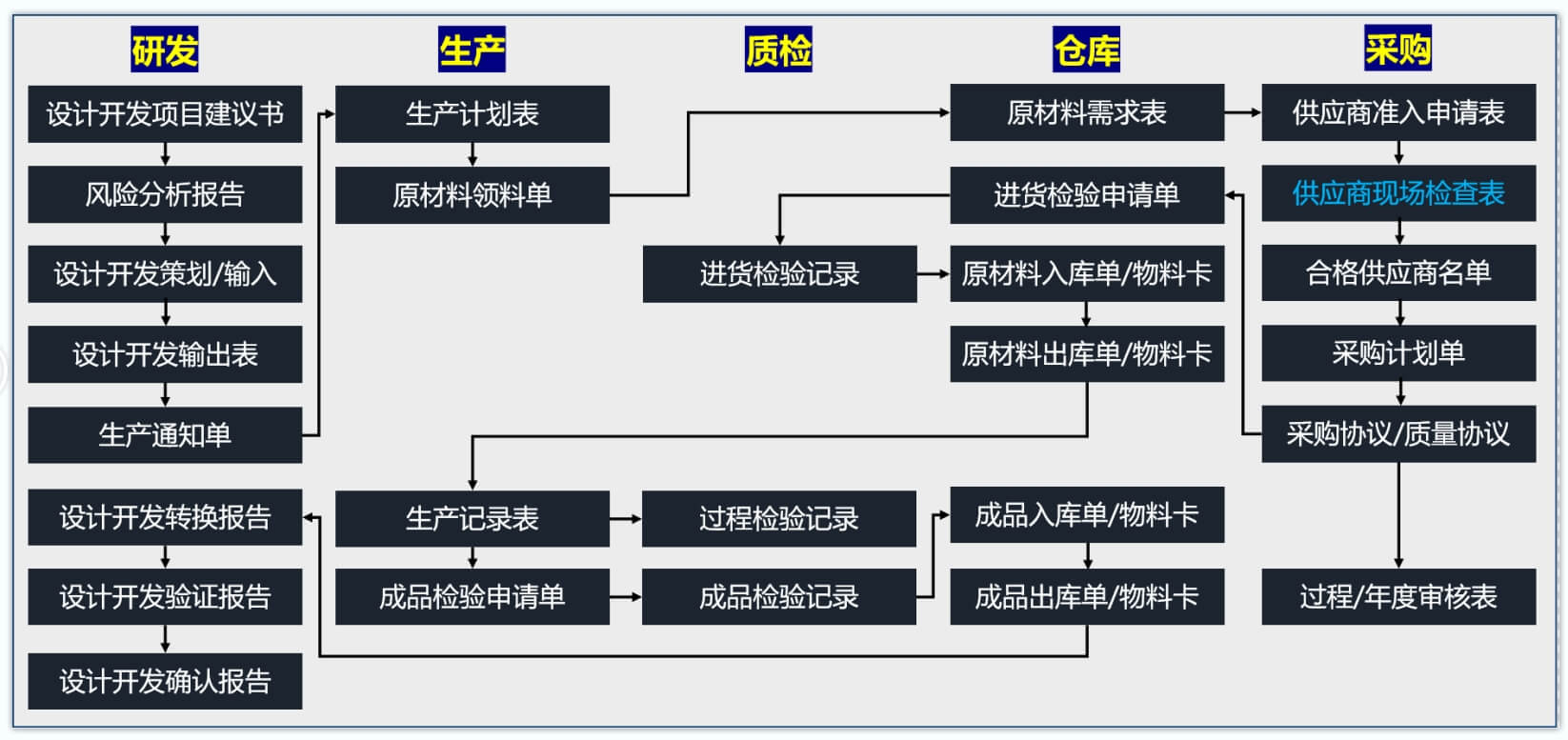
产品追溯的载体是各种质量记录,用于追溯的记录称为批记录。企业需要为每批次的产品建立批生产记录。
批生产记录可根据产品特点、企业性质制定,以普通非无菌医疗器械为例,其批记录可见下表:
表1 产品批记录表
| 产品名称 | 规格型号 | ||
| 产品数量 | 批号/编号 | ||
| 批记录类型 | 记录名称 | 记录编号 | 核对结果 |
| 采购记录 | 采购计划单 | QR-740-01 | |
| 采购合同 | QR-740-06 | ||
| 生产记录 | 生产记录表 | QR-750-03 | |
| 不合格品评审处理单 | QR-830-01 | ||
| 返工单 | QR-830-02 | ||
| 生产计划表 | QR-750-01 | ||
| 生产任务通知单 | QR-720-02 | ||
| 检验记录 | 进货检验记录 | QR-826-01 | |
| 过程检验记录 | QR-826-02 | ||
| 成品检验记录 | QR-826-03 | ||
| 让步接收申请单 | QR-830-03 | ||
| 仓储记录 | 领料单 | QR-750-02 | |
| 出库单 (原材料) | QR-758-02 | ||
| 入库单 (原材料) | QR-758-03 | ||
| 出库单 (成品) | QR-758-02 | ||
| 入库单 (成品) | QR-758-03 | ||
| 销售记录 | 产品销售记录表 | QR-720-03 | |
| 顾客反馈处理单 | QR-720-02 | ||
| 合同评审表 | QR-720-01 |
而用于各种批记录之间建立联系,确定某个产品对应的批记录,需要相应的信息要素进行区分。
单一规格型号的产品才能定位统一批次,因此需要有效追溯,批次内的产品追溯要素包括产品名称、规格型号、数量、日期、批号5大要素,见下图:

图|产品追溯的5大要素
产品批号管理
具体如下:
批次和批号
产品批次指生产条件相对稳定时所生产的具有同一性质和质量的某种产品确定的数量。产品批号即为每个批次的编号。
依据产品性质不同,每个批次产品数量可能为1个或多个,一般定制式产品、设备类产品每批产品为1个,单个产品的批号又称为编号或序列号。

图|批次的意义和类型
批号的编制
企业需要制定符合本公司要求的产品批号(LOT号),如企业已执行医疗器械UDI,则按UDI编码要求进行管理。
批号编码无法定的要求,只需要不重复即可,常见的批号编码参考如下:
原材料批号:原材料以生产厂家的批号为原材料批号。若无原材料生产厂家批号则以到货日期编号,由原材料到货日期的年、月、日共八位数字组成,前四位为年份,第五、六位为月份,第七、八位为日期,月、日期由两位数字组成(不足两位数的前面以0补齐),如:20230921。
产品批号/编号:产品成品以每个生产批编制产品批号/编号,成品批号/编号为九位数,例如202309001,其中前六位为生产开始日期,后三位为流水号。
质量记录的追溯
注册阶段的质量管理体系主要核查内容为:注册样品的真实性,人员、场地、设施设备的完整性,质量体系文件的符合性,质量记录的可追溯性。
其中样品真实性就是通过质量记录的可追溯性来证明。以普通非无菌产品为例,质量记录的可追溯性表格可见下表:
图|注册阶段质量记录可追溯性示意图
企业建立质量管理体系时,应充分参考《医疗器械生产质量管理规范》等法规要求,使质量记录类型和格式满足可追溯性要求。质量管理体系核查中涉及追溯性的常见不合格如下:
质量记录格式不正确
批记录中缺少上述追溯5大要素中的一项或若干项,导致产品无法追溯。
产品名称不一致
不同的质量记录中登记的同一个成品、原材料名称不一样。成品名称应和产品技术要求一致,原材料名称尽量采用厂家的名称。
规格型号不一致
同产品名称不一致情况。
数量不一致
不同的质量记录中登记的同一个成品、原材料数量无法平衡。企业在每批次产品生产结束后,应同时做物料平衡计算。
日期不符合逻辑
质量记录中记录的日期前后顺序和实际情况无法对应,如原材料采购日期在生产日期之后、成品检验日期在生产日期之前。此不合格涉及产品真实性,是体系核查的否决项。
批号不一致
不同的质量记录中登记的同一批成品、原材料批号不对应。企业在编制批号编码规则时,应尽量避免批号过于复杂,增加填写记录出错的几率。
常见问题
螺丝之类的原材料是否要追溯数量
原材料一般按照其重要程度进行分类管理,通常分为:
重要原材料(A类):对产品质量、性能起关键重要作用的物料。
一般原材料(B类):直接用于产品并对产品质量、性能起主要作用的物料。
辅助原材料(C类):对产品起辅助作用的物料。
质量管理体系中,A类、B类需要进行可追溯管理,C类原材料只需进行进货核验即可。螺丝一般为C类原材料。

原材料的采购发票是否需要追溯
原材料采购主要关注采购协议、质量协议、原材料合格证明文件,对于发票无要求。
如现场核查对企业产品真实性产生质疑,企业可通过提供原材料发票用以自证。
产品追溯是哪个部门的职责
通常情况下,企业接到客户投诉后,销售部门会将问题反馈至质量部门,由质量部门进行质量追溯,追溯过程中,需要按照上述追溯流程,由各部门进行配合。
质量记录要保存多久
产品批记录保存期限应不少于产品有效期,且不少于2年。如企业采用电子记录,一般为长期保存。
其他记录按长期保存,如设计开发记录、内部审核记录、管理评审记录、人员管理记录、文件控制记录等。
