《医疗器械生产质量管理规范》中4.4.1条款规定:应当建立健全质量管理体系文件,包括质量方针和质量目标、质量手册、程序文件、技术文件和记录,以及法规要求的其他文件。企业在使用相应的文件时,需要在文件上加盖“受控”章,即所谓受控文件。那么,何为文件受控?受控文件受到哪些控制?哪些文件属于受控文件?那些不属于受控文件?本文将予以解答。
什么是文件受控?
医疗器械质量管理体系(GMP)是一种文件化的产品质量管理方法,企业依据法规和标准,建立体系文件,对产品生产和质量相关的每个过程进行控制,并在过程完成后填报质量记录作为证据。
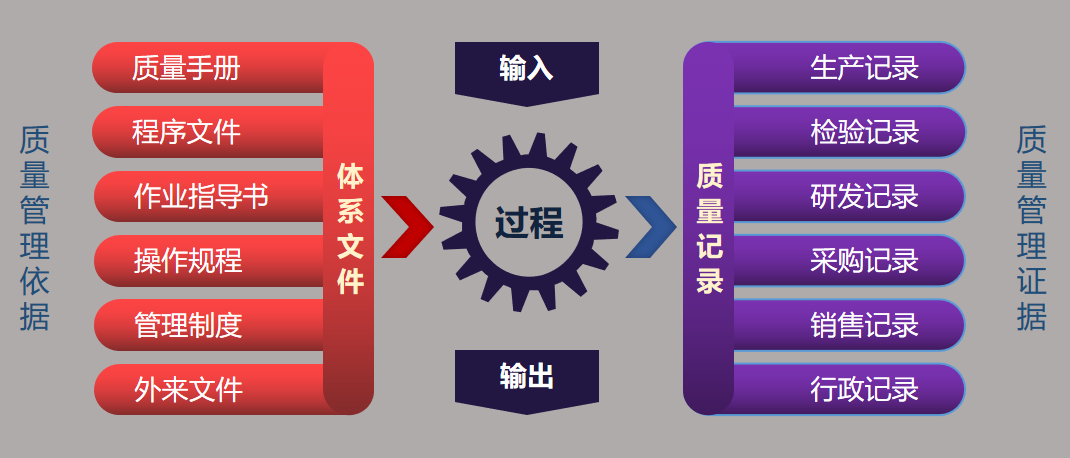
图|质量管理体系文件化管理关系图
体系文件在实施过程中,由于法规法规的变更、产品变更、工艺变更、体系改进等原因,需要对文件进行升级换版。文件变更换版后,即存在新旧两个版本的文件,企业在质量管理时,需要保证各个过程均需使用最新的版本文件。因此受控文件在文件换版时,需要回收旧版文件,并发放新版文件,防止误用。
据此,文件受控定义为:按照发放范围分发、收回,并保证使用者始终用的是最新版本的文件控制过程。
哪些文件需要受控?
企业自行编制的体系文件一般分为四级文件,包括质量手册、程序文件、三层文件、质量记录,如下图:
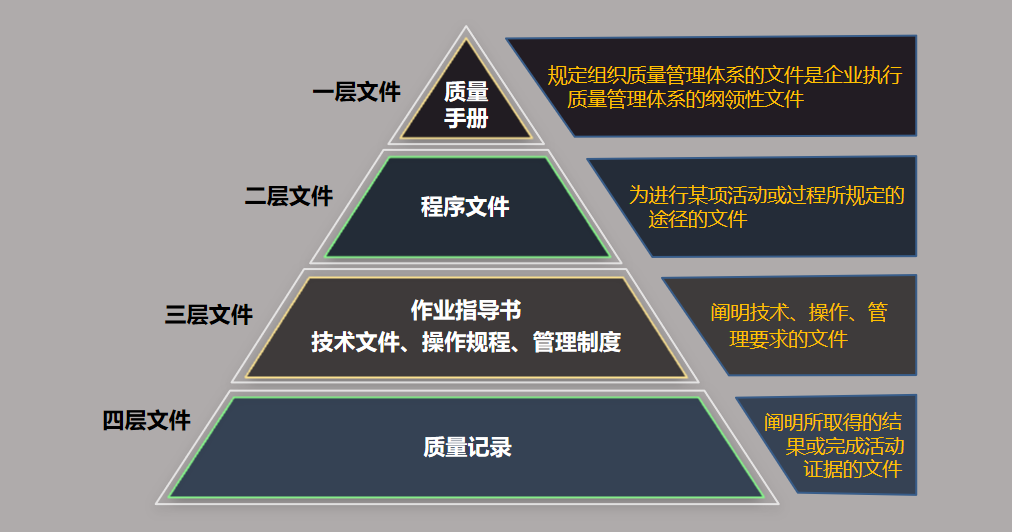
图|质量管理体系文件化管理关系图
同时由于企业执行体系管理时,还需要参考法律法规、标准、指南等非企业编制的文件,即外来文件。一般来说,需要受控管理的文件包括以下几个类型:
-
企业自用的体系文件
由企业内部编制,并发放给各部门使用的质量手册、程序文件、三层文件,需要保证始终按最新版本使用,因此内部使用的文件均为受控文件。
-
外来文件
法律法规、标准、指南等非企业编制的文件,发文部门亦会不定期进行换版升级,企业在建立体系时,需要参照相应的文件执行,因此需要保证内部使用的外来文件始终为最新版本,属于受控文件。
-
提供给委托生产企业的文件
如注册人按注册人制度申请注册证,在执行质量管理体系时,需要提供技术文件给受托企业,如产品技术要求、检验规程、工艺流程、SOP文件等,此类文件需要受托方始终按最新版本执行,因此属于受控文件。
-
提供给供应商的文件
部分企业在生产产品时,需要将部分工艺流程委托给外包方,或需要供应商按企业的要求生产零配件,需要提供工艺文件、产品图纸、电路设计图给供应商,此类文件需要供应商按最新版本执行,因此属于受控文件。
哪些文件为非受控?
某些文件在发放后,仅提供给第三方进行参考,此类文件换版后,无需告知对方进行文件回收发放,包括以下几类:
-
提供给监管部门的文件
用于产品注册申报、生产许可证申报的体系文件,包括质量手册、程序文件等,此类文件仅用于注册核查阶段提交给药监部门,后续文件有换版,不需要告知监管部门将文件予以回收和发放,同时药监部门也没有相应的申报通道可以接收企业的文件,此类文件为非受控文件,无需盖“受控”章。
-
提供给检测机构的文件
企业在注册时或产品研究时,需要将产品送至第三方检测机构进行产品检测,在此过程中需要提供技术文件,如产品技术要求、产品说明书等。此类文件具有一定的时效性,无需受控。
-
提供给咨询机构的文件
企业在建立质量管理体系过程中,由于自身能力有限,需要委托第三方机构协助建立质量管理体系,在此过程中,第三方机构向企业索取部门体系文件,如质量手册、程序文件等。体系建立后,由企业自行实施质量管理体系,因此也无需对交于第三方的文件进行管理,无需受控。
记录需不需要受控?
质量记录属于文件的一种,却具有其特殊性。质量记录包括两种状态,即空表格和已填写的记录。其中已填写的记录表格不得再进行修改,无需受控,而空表格的格式有可能进行修改,理论上需要进行受控管理。不过目前多数药监部门对记录受控管理无特别要求,企业可根据实际情况选择是否受控。
受控文件如何管理?
文件的受控管理是质量管理体系得以顺利运行的前提,文件受控管理主要注意以下几个问题:
-
由哪个部门进行文件受控管理?
企业内一般由行政部、质量管理部、QA部、文控部进行文控管理,对于初创企业或小规模企业,无需单独设立文控部门,优先由行政部进行管理。
-
受控文件需要编制哪些记录?
受控文件管理需要编制目录,并对文件的发放、回收、复印等进行管理,需要填写《受控文件目录》、《外来文件目录》、《文件发放回收记录》、《文件发放申请》、《文件复印记录》等记录。
-
文件的使用管理
受控文件需要审批后发放,文控部门按文件的发放范围进行文件发放,公司内部使用的受控文件不得带离所使用的场所。文件遗失需要填写申请表,向文控部门申请在发放,注明遗失原因。回收后的受控文件需要统一销毁处理,并保留一份备查。
-
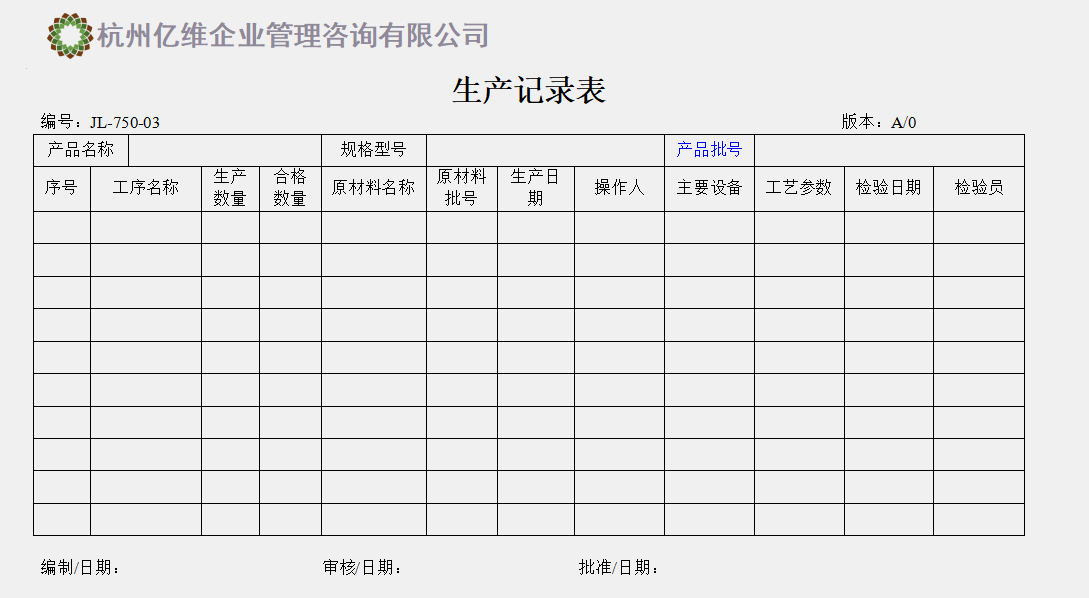
受控文件的编号管理
企业自行编制的受控文件需要进行标识管理,包括编制、审核、批准人员,文件的实施日期,文件编号、版本号等,加盖受控章方便识别管理,如下图:

图|受控文件管理示例
