医疗器械产品或材料在使用时,与人体直接或间接接触的部分,在与人体相作用过程中,可能会产生一系列不良反应,引起患者和操作者健康伤害。
因此,医疗器械在注册时,需要对医疗器械产品进行系统的生物学评价。
新版GB/T 16886.1-2022标准于2023年5月1日实施,本文结合GB/T 16886系列标准,以及医疗器械注册申报资料要求,对医疗器械生物学评价的评价要求和注意点进行说明。
产品所用材料
医疗器械产品依据不同的产品性质,使用的材料也各有不同。
其中预期和人体接触的部分一般为结构件、外壳、管路等部分,其材料选择为:金属材料、高分子材料、陶瓷材料、复合材料、生物材料。
其中金属材料、陶瓷材料较稳定,生物学性能较好。
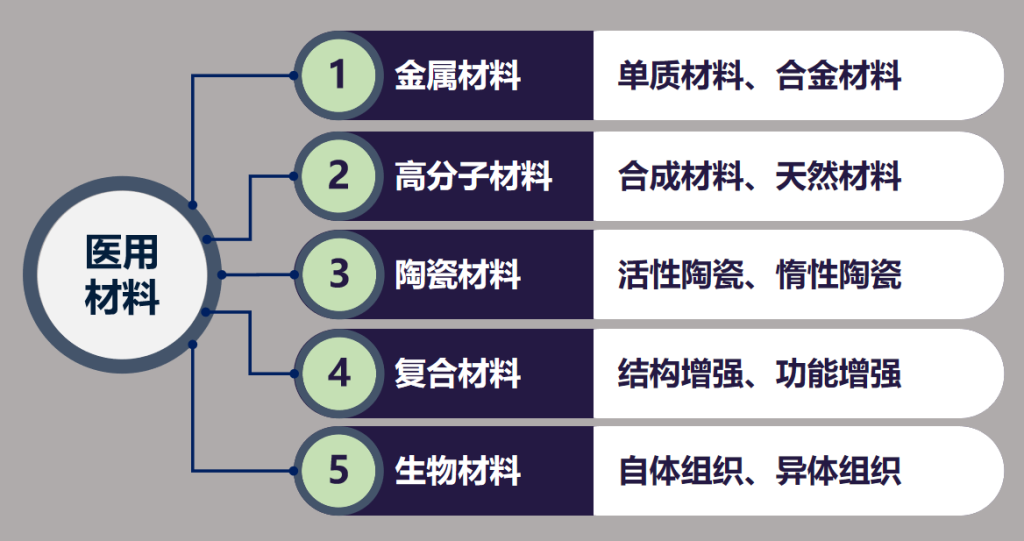
医疗器械产品在描述使用材料时,除了主要材料外,还要考虑生产过程引入污染物和残留物,以及可能产生的析出物(包括滤沥物和/或蒸发物)、降解产物、加工残留物。
| 材料类型 | 举例 |
| 生产过程引入污染物 | 脱模剂、消毒剂、灭菌剂(环氧乙烷) |
| 生产过程引入残留物 | 胶水、溶剂、染料 |
| 析出物 | 高分子聚合物发生裂解的单体、添加剂(稳定剂、 抗氧化剂、增塑剂、着色剂等) |
| 降解产物 | 可吸收类医疗器械 |
| 加工残留物 | 金属加工冷却液、润滑液,洗涤剂,氧化层 |
与人体接触性质
医疗器械产品和人体的接触性质决定了选择的生物学评价方式,接触性质具体为接触方式、接触部位、接触时间3个维度。
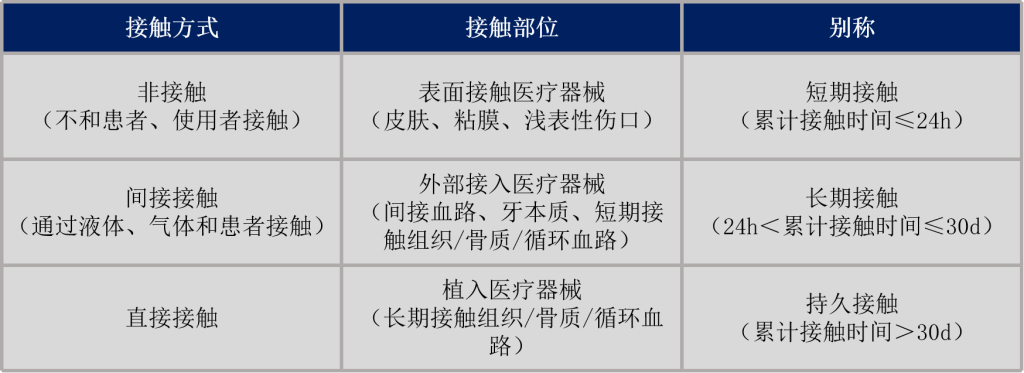
GB/T 16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》中附录A表A.1的项目进行医疗器械生物学评价试验。
常规医疗器械的生物学评价3项试验有细胞毒性、致敏反应和刺激或皮内反应3个试验。

物理和/或化学信息
新版的生物学评价标准以及注册要求需要申请企业提供接触人体材料的物理和化学信息。物理和化学信息包括配方加工过程、外观尺寸、物理性能(如熔点、裂解温度、密度),以及和人体接触的形式和临床使用方面的信息(如使用说明书),用于确定生物学评价方式。
材料的理化信息还可以包括牌号(反映材料的具体成分)、CAS号(反映物质的唯一性)等。
生物学评价的策略、依据和方法
企业依据医疗器械接触性质,选择生物学评价的项目和方法,评价依据为GB/T 16886系列标准。
一般来说用于生物学检测的样品为固体物质或凝胶,需要将样品浸提后用浸提液进行测试,通常为双浸提(极性溶液和非极性溶液浸提)。
生物学评价检测时,有可能因为样品问题,造成检测不合格。
其中高分子类的材料较容易产生不合格现象,且细胞毒性项容易不合格。因此在选择材料时,可优先选择食品级或医疗级材料。

注意点:
- 同样的产品无菌和非无菌产品需要分开送样。
- 非无菌产品在生物学检测前需要经环氧乙烷或湿热灭菌处理,因此选择的材料需要考虑灭菌适应性。
- 辐照灭菌、高温有可能造成高分子材料的裂解,不能作为豁免的依据。
- 考虑纺织品的染料、结构件的胶水等微量化学品的影响,尽量选择品牌产品,该类物质极易引起细胞毒性不合格。
已有数据和结果的评价
厂家可通过已有数据分析对产品生物学进行评价,已有数据包括:
- 本公司其他同类产品的生物学评价检测报告;
- 使用的材料厂家依据GB/T 16886/ISO10993系列标准进行的生物学评价检测;
- 产品前期临床使用信息(适用于延续注册、变更注册等情况);
- 有关材料生物学评价方面的文献。
生物学试验豁免
由于医疗器械临床评价试验比较耗费时间和精力,如常规3项2-3个月,亚慢性试验6个月以上,因此企业在注册产品时,可尽量选择豁免途径,包括以下几类方式:
- 瞬时接触医疗器械豁免
某些极为短期接触的器械可豁免生物学试验,如接触时间小于1分钟的手术刀、注射针头等。 - 接触方式改变豁免
部分产品预期使用时,可配合其他医疗器械或产品使用,使产品的接触性质由直接接触变为不接触。如佩戴手套接触设备外壳、使用医用垫单等隔离皮肤和医疗器械设备等。 - 已有数据评价豁免,见上节内容。
- 采用经注册/生物学检测的原材料
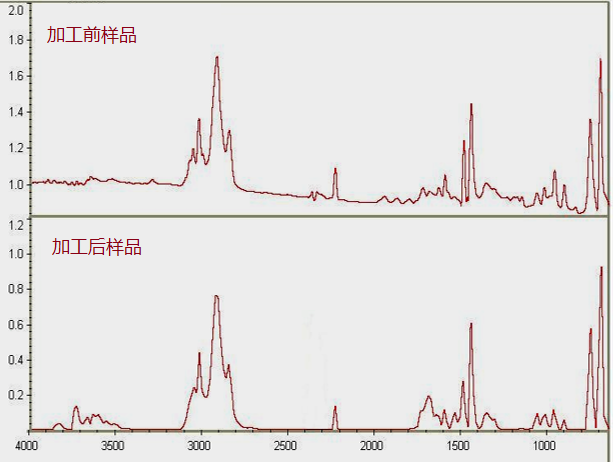
产品采用的原材料经注册或生物学检测合格,证明其生物学评价安全,如齿科材料等。但需要考虑加工过程是否改变产品的化学和物理性状。一般来说金属材料的热加工不会改变其性质,高分子材料的加工过程可能导致其化学成分变化,可通过红外光谱分析法,证明其材料性质加工前后一致。
- 配套使用的非医疗产品豁免
如与医疗器械配套使用的鼠标、键盘、触摸屏、计算机、手机等预期与使用者接触的部分可不做生物学检测。但需说明此类非医疗产品所用材料为市售常规的材料。
参考文献
[1]GB/T16886.1-2022《医疗器械生物学评价 第1部分:风险管理过程中的评价与试验》
[2]《医疗器械生物学评价和审查指南》(国食药监械[2007]345号)
[3]《医疗器械注册申报资料要求和批准证明文件格式》(2021年第121号)
