医疗器械注册主要分为产品检测、质量管理体系、临床评价、产品注册四个部分,由于医疗器械产品及其技术的多样性,临床评价成为其中不确定性最大的部分。一些产品已使用多年,其安全有效性、临床性能已得到充分认识。另一方面,许多产品采用了尚未应用于临床的新方法、新技术。此外,产品的结构组成、适用范围有较大差异,适用人群差异,均可影响临床评价的路径。
临床评价路径
临床评价指采用科学合理的方法对临床数据进行分析评价,以确认医疗器械在其适用范围下的安全性、临床性能和/或有效性的持续进行的活动。临床数据主要是来源于临床试验报告、临床文献和临床经验的临床数据
因此依据医疗器械临床数据来源的情况不同,临床评价可选择以下四种路径(方法)之一编制临床资料:

图|医疗器械临床评价路径
需要注意的是,豁免临床评价的产品在注册时也需要提供临床评价资料,描述产品临床豁免的依据,以及和已注册的同类产品对比说明。
而不在豁免目录中的产品不一定要做临床试验,实际上,药监总局的审评思路是让企业尽量以非临床试验的路径来提交临床评价资料,临床试验往往作为最后的选择,是否可以避免临床试验可见下图:
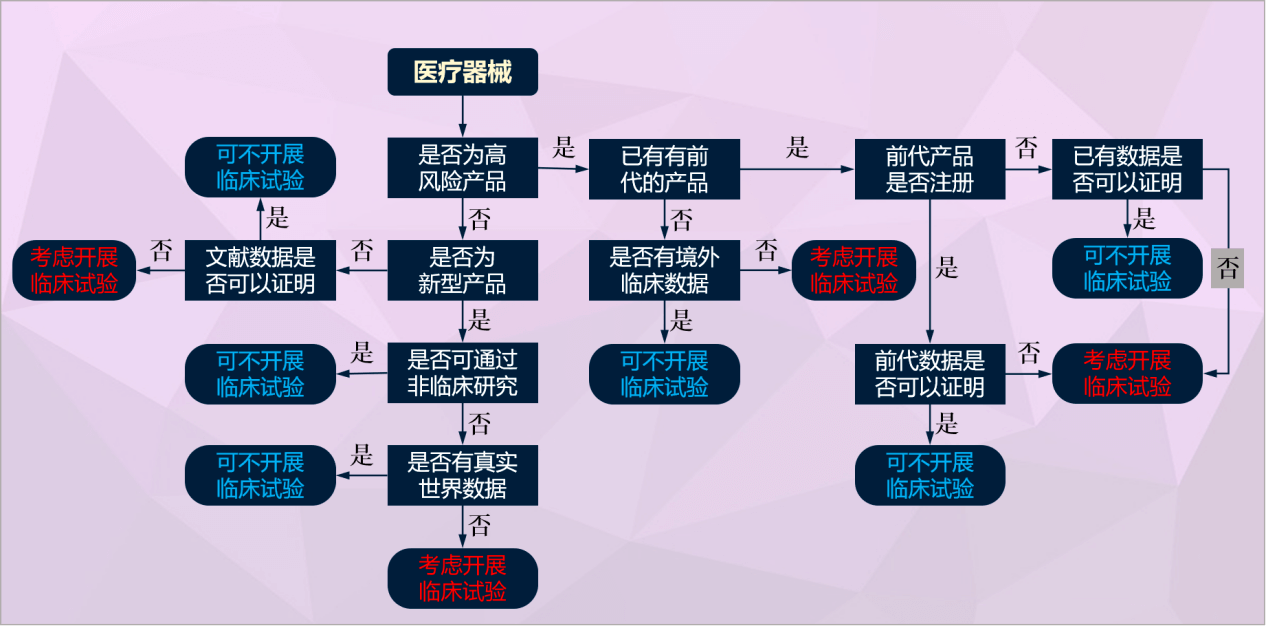
图|医疗器械临床试验决策流程图
同品种临床对比
医疗器械临床评价豁免目录里的产品属于上市多年、技术成熟、风险相对较低的常规产品。不在豁免目录里的产品如果通过临床试验路径进行临床评价则耗时耗力,成本非常高。因而,通过同品种临床对比的方式不失为一种极具性价比的临床评价方式。
同品种临床对比包括获取同类产品的临床试验资料、通过临床文献两种方式,由于获取同品种临床试验资料极为困难,因此同品种对比一般指通过临床文献方式进行临床评价。
理论上只要有同类产品取得注册证并上市销售,即可通过同品种对比的方式进行临床评价,评价的流程如下:
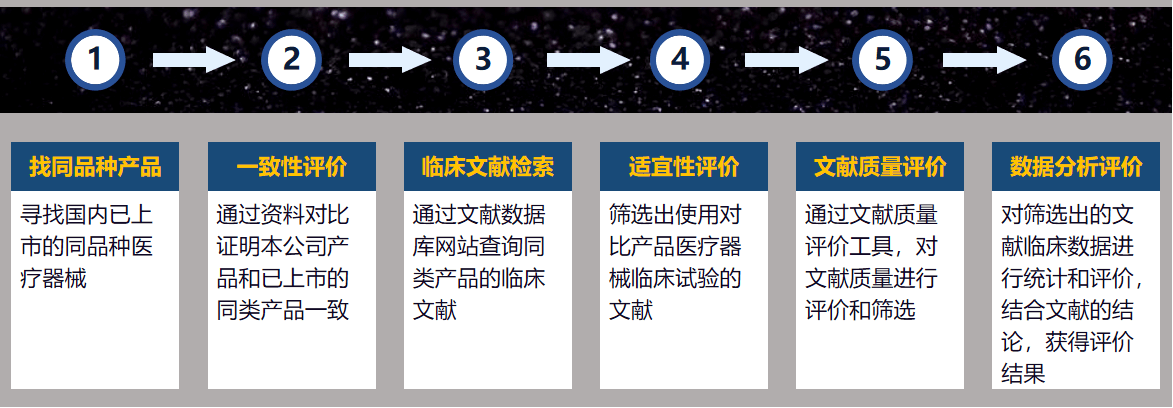
图|同品种临床评价流程
同品种产品
同品种产品指用于对比的已取得注册证的产品,且对比产品在结构组成、预期用途等方面与本公司产品一致。同品种产品可选择一个或多个,国产产品或进口产品均可。选择同品种产品需要注意以下要求:
表1 同品种产品选择要点
| 序号 | 项目 | 要求 |
| 1 | 注册情况 | 产品需要取得注册证,且上市时间越长越好 |
| 2 | 产品名称 | 产品名称尽量一致 |
| 3 | 结构组成 | 产品结构、主要原材料、软件核心功能需一致 |
| 4 | 预期用途 | 不小于本公司的产品预期用途 |
| 5 | 不良事件 | 上市后无不良事件 |
| 6 | 技术指标 | 能获取产品技术指标(产品技术要求) |
| 7 | 临床文献 | 该产品有临床文献、公开资料等 |
一致性评价
择好适合的同品种对比产品后,需要对双方的产品进行一致性评价,证明两者具有等同性,可作为临床评价的依据。
同品种一致性评价围绕适用范围、技术特征、生物学特征三个方面开展评价,评价的判定可参考下表:
表1 同品种一致性评价标准
| 项目 | 内容 | 一致性评价判定 |
| 适用范围 | 适应证、适用人群 | 适用范围明显不同,不能作为对比产品 |
| 适用部位 | 如没办法和对比产品一致,不能作为对比产品 | |
| 与人体接触方式和时间 | 如没办法和对比产品一致,不能作为对比产品 | |
| 疾病的严重程度和阶段 | 如没办法和对比产品一致,不能作为对比产品 | |
| 使用条件 | 尽量和对比产品一致 | |
| 重复使用 | 如没办法和对比产品一致,不能作为对比产品 | |
| 使用方法、禁忌证 | 尽量和对比产品一致 | |
| 警告及预防措施 | 尽量和对比产品一致 | |
| 技术特征 | 工作原理、作用机理 | 尽量和对比产品一致 |
| 产品组成、产品结构 | 尽量和对比产品一致 | |
| 申报器械的重大特性 | 尽量和对比产品一致 | |
| 材料 | 如没办法和对比产品一致,需要论证材料特性 | |
| 能源 | 如没办法和对比产品一致,不能作为对比产品 | |
| 产品性能、功能及其他关键技术特征 | 对比技术指标,尽量和对比产品一致 | |
| 生物学特性 | 如降解性能、生物学反应 | 如没办法和对比产品一致,不能作为对比产品 |
评价的依据可参考同品种产品的公开信息,如说明书、产品技术要求、产品本身等。如有差异部分,可通过以下方式证明安全有效性:
1、模型试验;
2、动物试验研究;
3、产品测试对比;
4、同品种临床数据集分析;
5、临床使用需求角度论述差异;
6、小样本临床研究。
临床文献检索
确定对比产品后,可通过文献检索网站检索相应的临床论文,检索网站一般为中国知网 CNKI、万方数据、维普数据等网站。检索到合适的文献后,可下载备用。
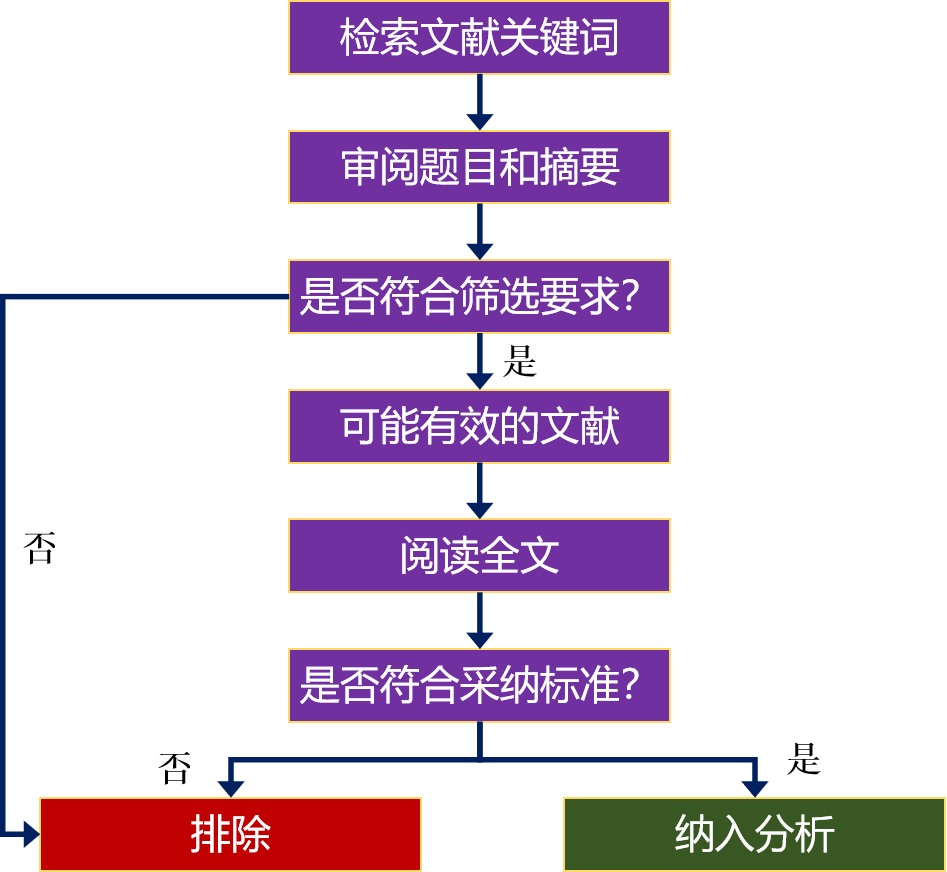
图|临床文献检索流程
检索的文献要发表在学术期刊上,文献需要有临床使用病例,一般来说有效文献至少要2篇以上,文献记载的病例数应满足临床试验病例数要求。
适宜性评价
临床文献是指用特定的医疗器械,通过在医疗机构进行临床试验,获取数据而公开发表的论文。包括国内期刊文献和国外期刊文献,如采用国外文献,还需对文献进行全文翻译。国外的文献可能涉及人种差异等问题,一般不建议采用。
对于筛选的文献需要进行适宜性评价,以确定文献对临床评价的适用性,评价内容可见下表:
表3 文献适宜性评价

文献质量评分
同品种临床评价本质上属于间接的临床试验,通过对同品种产品在临床上的使用情况证明产品的安全有效性,因此临床文献里采用的临床研究方法应尽可能满足医疗器械临床试验的要求。
文献的研究方法越接近临床试验方法(随机、对照、盲法),则文献质量越高。文献质量评分的方法有很多种,常见的评价方法有Jadad评分量表(基于随机和盲法的评分量表)、OCEBM法(牛津循证医学中心证据等级),见下图:

图|Jadad评分量表法

图|牛津循证医学中心证据等级
数据分析评价
文献质量评价合格的文献,需要对文献记载的临床数据进行分析,以确认该次临床研究的有效性,单篇文献数据分析的主要内容为临床研究方法、病例纳入标准、病例数(含对照数)、数据分析,形成结论。临床文献数据分析见下表:
表4 单篇文献数据分析评价示例
| 题目 | 中耳负压治疗仪治疗儿童慢性分泌性中耳炎的疗效观察 | 研究类型 | RCT |
| 目的 | 分析在实施儿童慢性分泌性中耳炎患儿治疗的过程中,中耳负压治疗仪的临床应用效果与价值 | 证据水平 | 1b |
| 研究方法 | 本次实验研究对象为2019年10月~2020年10月收治的64例儿童慢性分泌性中耳炎患儿,其中以中耳负压治疗仪作为治疗方法的32例患儿作为观察组,接受传统治疗方法治疗的32例患儿作为对比组。 | ||
| 病例纳入标准 | 本次实验研究将2019 年10 月~2020 年10 月本院接受儿童慢性分泌性中耳炎患儿64 例作为实验对象,根据掷硬币分组法将患儿分为观察组(n=32)与对比组(n=32)。观察组中有18 例为男患儿,14 例为女患儿,患儿年龄3~13 岁,平均(7.89±1.64)岁,病程1~6个月,平均(2.36±0.54)个月;对比组中有17 例为男患儿,15 例为女患儿,患儿年龄4~14 岁,
平均(8.02±1.58)岁,病程26d~5.5个月,平均(2.29±0.61)个月,两组患儿上述一般资料差异并无统计学意义,P>0.05。 纳入标准:符合儿童慢性分泌性中耳炎的诊断标准;可以很好地配合医护人员的相关操作;临床资料完整;患儿家属知情并同意参与本次实验研究。 排除标准:存在其他中耳手术史;患儿不能配合医护人员相关操作;患儿家属不了解或者是不同意参与本研究的患儿。 |
||
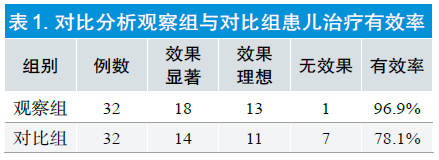
| 数据分析 | 与对比组患儿相比,观察组患儿治疗有效率明显较高,P<0.05,详见表1。
统计学分析两组患儿平均气导听阀、平均气骨导差以及A/N比值后可知,治疗前观察组与对比组患儿差异并无统计学意义,P>0.05;治疗后观察组与对比组患儿差异具有统计学意义,P<0.05,详见表2。
|
||
| 结果 | 两组患儿治疗效果、治疗后平均气导听阀、平均气骨导差以及腺样体、鼻咽腔比值(A/N比值)差异显著,P<0.05。 | ||
| 研究结论 | 在实施儿童慢性分泌性中耳炎患儿治疗的过程中中耳负压治疗获得了理想的治疗效果。 | ||
同品种对比结论
通过对每篇适用的文献的结论进行进行综合分析,获得该同品种产品的临床适用结论,以此证明产品的安全有效性。
按照上述的每个流程的输出结果,依据《医疗器械临床评价技术指导原则》的要求,编制形成《同品种临床评价报告》。
注意:由于同品种产品和注册产品之间差异较大,或由于临床文献不充分,同品种临床评价有不成功的可能性。一旦不成功,企业只能选择临床试验路径进行评价。