医疗器械年度自查报告是医疗器械企业每年度重要工作,根据《医疗器械监督管理条例》等法规的规定,从事医疗器械产品生产的注册人、备案人、生产企业,以及从事第二类、第三类医疗器械经营的企业,应当按照本相关方法规范进行质量管理自查,并与每年3月31日前向药品监督管理部门提交上一年度的自查报告。自查报告内容应当真实、准确、完整和可追溯。
一、医疗器械质量管理年度自查报告
按照法规要求,医疗器械生产企业和销售企业需要建立质量管理体系或质量管理制度,保证产品生产和销售过程的质量稳定。质量管理体系是企业正常经营的保证以及各级药监部门对企业经营行为进行监督管理的重要内容,因此药监部门需要掌握企业在本年度内质量管理的相关情况,除了日常监督检查、飞行检查外,还需要企业根据自身情况,将本年度的体系运行情况、变更情况予以上报。
体系自查报告目前均以网络申报的形式进行提交,其中生产企业,包括第一类、第二类、第三类医疗器械的生产企业,以及为注册人提供委托生产的企业,需要向国家药监局的申报系统提交报告。经营企业,包括医疗器械的经营公司,以及为其他企业提供存储配送的第三方物流企业,需要向所在地市级或区县级药监局提交报告。
提交报告的期限为每年3月31日之前,一般来说,每年的1月中旬开始,即可提交自查报告,如逾期没有提交,会影响企业在下个年度的正常运行或企业变更业务办理,严重的会接受相应行政处罚。企业因指定专人负责每年度的自查报告提交工作,避免延误。
二、生产企业年度自查报告申报
《医疗器械质量管理体系年度自查报告编写指南》规定,医疗器械注册人、备案人、生产企业每年需要向药监部门提交年度医疗器械质量管理体系自查报告,报告的填报内容为当年度1月1日至12月31日经营信息和统计数据,应于次年3月31日之前提交。
1.自查报告申报网站
如当地药监部门没有特别说明,自查报告均在国家药监局官网上申报提交,注册人需要在国家药监局官网上注册账号,见下图:

图|国家药品监督管理局注册登录界面
2.申报流程
注册账号后,登录网页,点击“我的绑定”→“医疗器械生产企业监管信息系统”,见下图:
 打开界面后,需要完善企业基本信息和产品基本信息。申报质量管理体系自查报告时,点击“年度自查报告”→“新增”,按界面要求填报,见下图:
打开界面后,需要完善企业基本信息和产品基本信息。申报质量管理体系自查报告时,点击“年度自查报告”→“新增”,按界面要求填报,见下图:

3.自查报告
在网站界面上按照企业实际情况要求,填写对应内容,填报内容参考范本如下:




三、经营企业年度自查报告申报
《医疗器械经营质量管理规范》规定,医疗器械经营企业每年需要向所在地市级药监部门提交年度医疗器械质量管理体系自查报告,报告的填报内容为当年度1月1日至12月31日统计数据,应于次年3月31日之前提交。
1.自查报告申报网站
经营企业归各地市级市场监督部门监管,实际监督已下放至区县级市场监管部门。经营企业需要关注所在地监管部门的要求以及对应的申报网站,及时进行申报。以浙江省为例,目前省经营企业均在浙江政务网上申报,企业在申报时,需要注册法人账号。
2.申报流程
登录法人账号后,搜索“医疗器械经营企业年度自查报告”,点击第一个搜索结果对应的在线办理,见下图:
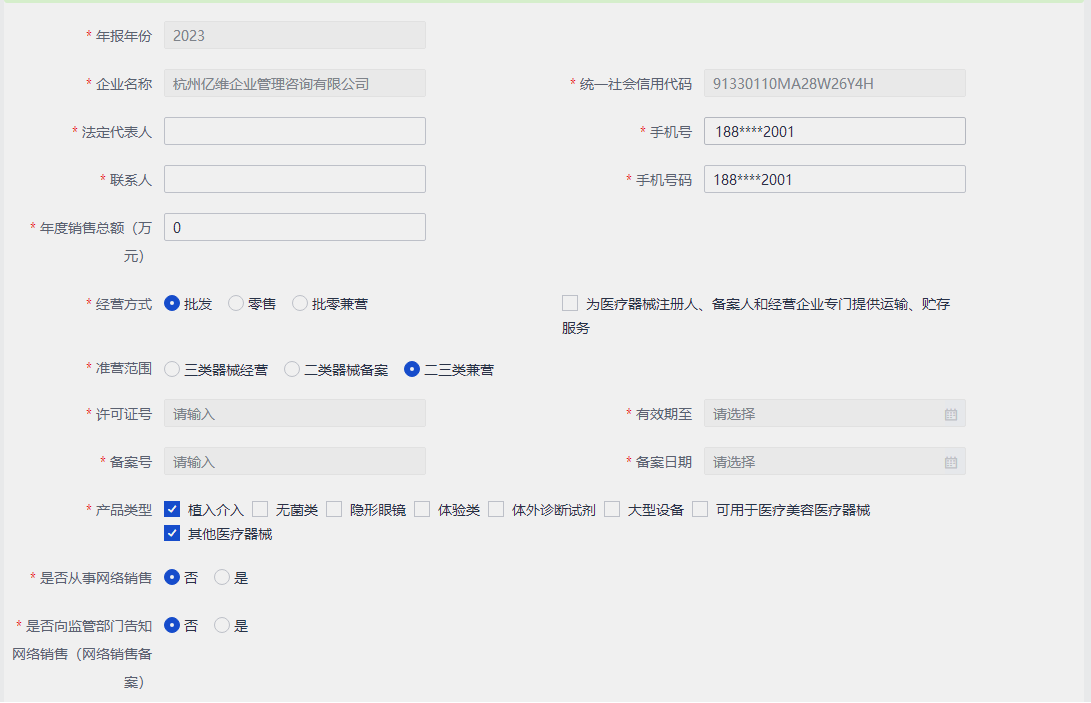
按照网站的指引,进入在线填表页面,见下图:

按企业经营的实际情况填写相应内容,参考格式如下:

3.自查情况
填报好基本信息后,需要填写自查情况,界面见下图:

自查报告需要在线编辑填报,经营企业需要根据上年度实际经营情况,如实填报相应的内容,参考的填写范本如下:
| 序号 | 自查内容 | 提示内容 | 是否存在 | 情况描述 |
| 1-1 | (从事医疗器械批发业务的经营企业)是否存在销售给不具有资质的经营企业或者使用单位的情形? | 否 | 无此类情况发生 | |
| 1-2 | 是否存在从不具有资质的生产、经营企业购进医疗器械的情形? | 否 | 无此类情况发生 | |
| 2-1 | 是否存在经营条件发生变化,不再符合医疗器械经营质量管理规范要求,未按照规定进行整改的情形? | 否 | 经营条件没有发生变化 | |
| 2-2 | 是否存在擅自变更经营场所或者库房地址,扩大经营范围或者擅自设立库房的情形? | 否 | 经营场所和库房没有变化 | |
| 3-1 | 是否存在提供虚假资料或者采取其他欺骗手段取得《医疗器械经营许可证》的情形? | 否 | 无此类情况发生 | |
| 3-2 | 是否存在未办理经营备案或者经营备案时提供虚假资料的情形? | 否 | 无此类情况发生 | |
| 3-3 | 是否存在伪造、变造、买卖、出租、出借《医疗器械经营许可证》或《医疗器械经营备案凭证》的情形? | 否 | 无此类情况发生 | |
| 4-1 | 是否存在未经许可从事第三类医疗器械经营活动的情形? | 否 | 无此类情况发生 | |
| 4-2 | 是否存在《医疗器械经营许可证》有效期届满后未依法办理延续、仍继续从事医疗器械经营的情形? | 否 | 经营许可证在有效期内 | |
| 5-1 | 是否存在经营未取得医疗器械注册证的第二类、第三类医疗器械,特别是进口医疗器械境内代理商经营无证产品的情形? | 否 | 无此类情况发生 | |
| 6-1 | 是否存在经营不符合强制性标准或者不符合经注册或者备案的产品技术要求的医疗器械的情形? | 否 | 无此类情况发生 | |
| 6-2 | 是否存在经营无合格证明文件、过期、失效、淘汰的医疗器械的情形? | 否 | 无此类情况发生 | |
| 7-1 | 是否存在经营的医疗器械的说明书、标签不符合有关规定的情形? | 否 | 无此类情况发生 | |
| 7-2 | 是否存在未按照医疗器械说明书和标签标示要求运输、贮存医疗器械,特别是未对需要低温、冷藏医疗器械进行全链条冷链管理的情形? | 否 | 本公司没有经营需冷藏冷冻的医疗器械,无此类情况发生 | |
| 8-1 | 是否存在未按规定建立并执行医疗器械进货查验记录制度的情形? | 否 | 无此类情况发生 | |
| 8-2 | 是否存在从事第二类、第三类医疗器械批发业务以及第三类医疗器械零售业务的经营企业未按规定建立并执行销售记录制度的情形? | 否 | 销售记录完整 | |
| 9-1 | 是否存在违反医疗器械经营质量管理规范(GSP)的情形? | 否 | 无此类情况发生 | |
| 9-2 | 是否存在被监管部门立案处罚的情形? | 否 | 无处罚记录 | |
| 10-1 | 是否存在未按规定备案从事医疗器械网络销售或未按规定从事网络销售行为的情形? | 否 | 本公司无网络销售 | |
| 10-2 | 是否存在备案信息发生变化,未按规定网络销售备案变更的行为? | 否 | 本公司无网络销售 | |
| 10-3 | 是否在其主页面显著位置展示其医疗器械生产经营许可证件或者备案凭证?产品页面是否展示该产品的医疗器械注册证或者备案凭证? | 否 | 本公司无网络销售 | |
| 10-4 | 在网上发布的医疗器械名称、型号、规格、结构及组成、适用范围、医疗器械注册证编号或者备案凭证编号、注册人或者备案人信息、生产许可证或者备案凭证编号、产品技术要求编号、禁忌症等信息,是否与经注册或者备案的相关内容保持一致? | 否 | 本公司无网络销售 | |
| 11-1 | 是否存在未配备医疗器械物流管理机构、人员及设施设备的情形?是否存在机构人员不符合岗位配置与素质要求,设施设备与与所提供运输、贮存服务规模不相适应的情形? | 否 | 无此类情况发生 | |
| 11-2 | 是否存在未配备计算机信息管理系统,或计算机信息管理系统与所提供的医疗器械运输、贮存业务要求不相适应,无法对医疗器械的运输、贮存全过程实行动态管理和控制的情形? | 否 | 无此类情况发生 | |
| 11-3 | 是否存在未与委托方签订书面协议,明确运输、贮存的服务范围与质量管理要求,约定双方质量责任和义务的情形?是否存在企业质量管理体系无法覆盖运输、贮存服务全过程的情形? | 否 | 无此类情况发生 |
